安全性情報適正使用ガイドより抜粋
注意を要する副作用とその対策
肝機能異常
- ALT、AST及びγ-GTP増加を含む肝機能異常の発現が報告されています。肝機能障害(Child-Pugh分類クラスA、B)を有する患者に本剤を投与する場合は、特に注意して観察してください。
発現状況
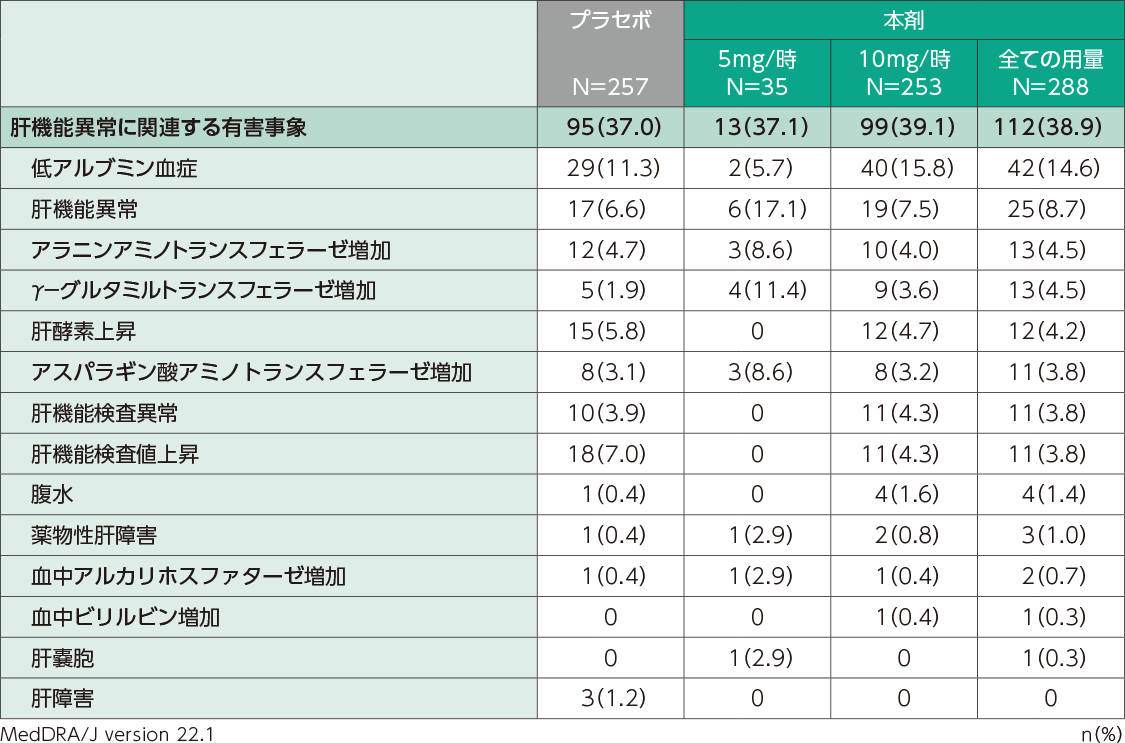
国内第Ⅱ相及び第Ⅲ相臨床試験での肝機能異常関連の有害事象の発現割合は、本剤投与群で38.9%(112/288例)、プラセボ群で37.0%(95/257例)でした。主な有害事象は、低アルブミン血症[本剤投与群14.6%(42/288例)、プラセボ群11.3%(29/257例)]、肝機能異常[本剤投与群8.7%(25/288例)、プラセボ群6.6%(17/257例)]でした。
肝機能異常に関連する有害事象(日本人安全性解析対象集団)
対処法
異常が認められた場合には、本剤の投与を中止するなど適切な処置を行ってください。
- 6. 用法及び用量
- 通常成人には、クラゾセンタンとして300mg(12mL)を生理食塩液500mLに加え、容量型の持続注入ポンプを用いて、17mL/時の速度で静脈内に持続投与する(クラゾセンタンとして10mg/時)。くも膜下出血術後早期に本剤の投与を開始し、くも膜下出血発症15日目まで投与する。なお、肝機能、併用薬に応じて適宜減量する。



